為確保藥品安全、有效和質量可控,國家對批準上市的藥品實行再注冊制度。本文將系統梳理陜西省國產藥品再注冊審批的關鍵信息,包括申請條件、收費標準、材料清單、辦理流程,并介紹相關的代理與繳費服務,為相關企業提供實用參考。
一、 申請條件
根據《藥品注冊管理辦法》,申請國產藥品再注冊,藥品批準文號持有人(以下簡稱“持有人”)需滿足以下基本條件:
- 文號有效:持有的藥品批準文號在有效期內(通常為5年)。
- 符合法規:藥品生產符合《藥品生產質量管理規范》(GMP)要求。
- 持續合規:在藥品批準文號有效期內,該藥品生產、銷售、不良反應監測等情況符合國家相關規定,未出現嚴重質量問題或安全隱患。
- 資料完整:能夠按照要求提交完整的再注冊申請資料。
- 其他要求:符合國家藥品監督管理局及陜西省藥品監督管理局規定的其他條件。
二、 收費標準及依據
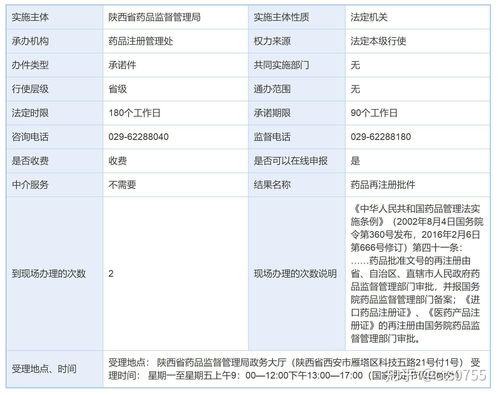
目前,國產藥品再注冊審批不收取官方的審批費用。
依據:根據國家發展改革委、財政部關于藥品、醫療器械產品注冊收費標準的相關通知,國產藥品再注冊暫未設立收費項目。但申請人需自行承擔資料準備、檢驗檢測(如需要)、第三方服務等相關成本。
三、 申請材料清單
申請人需向陜西省藥品監督管理局提交以下材料(具體要求以最新官方指南為準):
- 《藥品再注冊申請表》:通過國家藥品監督管理局網上辦事大廳在線填報并打印。
- 證明性文件:
- 藥品批準證明文件及其附件的復印件(包括藥品注冊批件、補充申請批件、藥品標準等)。
- 藥品生產許可證及其變更記錄頁復印件。
- 《藥品生產質量管理規范》認證證書復印件。
- 營業執照復印件。
- 五年內生產、銷售、抽驗、不良反應監測情況報告:詳細說明藥品的生產批次、銷售數量、質量抽檢結果、不良反應收集與處理情況等。
- 五年內藥品制劑變更情況報告:匯總并說明所有已批準的變更(如工藝、場地、質量標準等)。
- 藥品處方、生產工藝、質量標準、藥品說明書和標簽樣稿:需與現行批準內容一致,如有變更應已獲批。
- 生產藥品制劑所用原料藥的批準證明文件(如為制劑)。
- 藥品最小銷售單元的包裝、標簽和說明書實樣。
- 申請人對其申請材料真實性負責的承諾書。
- 省局要求的其他資料。
四、 辦理流程
- 網上填報:登錄“國家藥品監督管理局網上辦事大廳”,在線填寫并提交《藥品再注冊申請表》。
- 材料準備與自查:根據清單準備全套紙質申請材料,并確保內容真實、完整、規范。
- 提交申請:將紙質申請材料報送至陜西省藥品監督管理局受理大廳(或通過郵寄方式)。
- 受理審查:省局對材料進行形式審查,符合要求的予以受理,出具受理通知書;不符合要求的,一次性告知需要補正的內容。
- 技術審評與審批:省局組織對申請材料進行技術審評,必要時進行現場檢查或抽樣檢驗。審評通過后,作出予以再注冊或不予再注冊的審批決定。
- 領取批件:審批通過后,持有人憑受理通知書及相應憑證領取《藥品再注冊批件》。
總辦理時限:通常為120個工作日(不含申請人補正材料的時間)。
五、 干貨分享:代理辦理輔導與繳費服務
對于不熟悉流程、人力緊張或希望提高效率的企業,可以尋求專業的第三方服務。
- 代理辦理輔導服務:
- 服務內容:專業機構提供從政策解讀、申請方案制定、資料撰寫與審核、申報系統操作指導到進度跟蹤、溝通協調等全流程或關鍵環節的輔導與代理服務。
- 價值:幫助企業規避常見錯誤,確保材料質量,節省時間成本,提升申報成功率。
- 選擇建議:選擇在陜西本地有豐富藥品注冊經驗、信譽良好的咨詢公司或律師事務所,并確認其服務團隊的專業資質。
- 本地及異地代繳費服務:
- 服務說明:雖然再注冊本身無官方收費,但在藥品生命周期中,企業可能涉及其他相關規費(如藥品補充申請費、檢驗費等)。一些代理機構或金融服務平臺可提供便捷的代繳服務。
- 本地服務:通常由本地代理機構直接代為處理向省內相關部門繳納的費用。
- 異地服務:主要針對持有人所在地與陜西省外,需要向國家局或外省機構繳費的情況,通過委托代理進行跨區域支付,解決異地奔波問題。
- 注意事項:選擇代繳費服務時,務必核實服務提供方的正規性與安全性,明確費用明細和服務協議,保障資金安全。
****:陜西國產藥品再注冊是一項法規性、專業性強的常態化工作。持有人應提前規劃,嚴格對照條件與清單準備,亦可借助專業服務確保流程順暢,從而保障藥品批準文號的持續有效性,保障企業正常生產經營。